
LA SAXITOSSINA
La saxitossina, così detta perchè isolata per la prima volta dal bivalve Saxidomus giganteus, è responsabile di un tipo di intossicazione detta PSP (Paralityc Shellfish Poisoning). Anni fa, Masaaki Kodama (Kitasato University), isolò dei batteri presenti in un’alga, la dinoflagellata Alexandrium tamarense, e dimostrò che erano gli stessi batteri a produrre la tossina e non l’alga in questione. Tuttavia dopo ulteriori studi si evidenziò che colture batteriche anche molto abbondanti producevano quantità limitate della tossina, per cui si misero di nuovo in dubbio tutti i risultati ottenuti fino a quel momento. L’idea che circolava, era che i batteri avessero la capacità di produrre metaboliti tossici solo in condizioni particolari (simbiosi, mutualismo ecc..), mentre tale capacità si esauriva nel caso di batteri isolati. Solo più tardi furono indagate di nuovo le alghe e altri organismi.
La composizione elementare della saxitossina (C10H19N7O4) venne determinata nel 1962, e poco dopo ad opera di E.J. Schanz (1975) venne determinata per cristallizzazione anche la struttura tridimensionale. La struttura molecolare è tale da garantire una elevata stabilità in soluzioni fisiologiche, inoltre la sua tossicità è notevole e dipende naturalmente dalla via di somministrazione (orale, intramuscolare, sottocutanea, endovenosa). Nel topo la LD50 (Lethal Dose, dose letale che abbatte almeno il 50% degli organismi testati) va da 3.5 μg/Kg (via endovenosa) a 260 μg/Kg (somministrazione orale). Nei molluschi filtratori la concentrazione può essere tale da causare seri problemi anche all’uomo, sopratutto se il pescato proviene da una zona soggetta ad una marea rossa (red tides) caratterizzata dalla presenza di milioni di cellule algali per litro. E’ avvenuto per esempio nel 1976 con il consumo di bivalvi contaminati raccolti in Atlantico ed esportati in Europa, Italia compresa. In tal caso si è avuta una vera e propria epidemia PSP. Da ricordare che la tossina può rimanere nei bivalvi anche per giorni e mesi dopo la prima esposizione, inoltre è termostabile, e resiste bene a varie metodologie di conservazione degli alimenti. Si degrada dopo ore di bollitura a pH 3. 
La saxitossina (STX), e le sue oltre 20 varianti, sono sintetizzate e/o si trovano in un gran numero di organismi, sia marini che di acqua dolce, anche se per l’uomo solo i molluschi costituiscono un rischio vero e proprio. Attualmente, sono note otto specie di cianobatteri e un numero crescente di dinoflagellate (quasi tutte del genere Alexandrium, figura a lato), che sono in grado –si presume nel caso delle dinoglagellate- di sintetizzare la STX. Sono note anche diverse specie di crostacei, di echinodermi, di molluschi gasteropodi e molte specie di bivalvi, tra cui Mytilus edulis, Mytilus galloprovincialis, Mytilus californianus e Mytilus chilensis che possono contenere ma che probabilmente non sintetizzano, la saxitossina. Tra i pesci sono note quattro specie del genere Takifugu, diffuse in Cina e nel sud-est asiatico. La via biosintetica comincia con la PST (paralityc shellfish toxins), prodotta da pochi cianobatteri di acqua dolce e da alcune dinoflagellate. In quest’ultimo caso tuttavia, non è stato ancora accertato se si tratti di una sintesi ex novo vera e propria, potrebbero essere infatti responsabili della sintesi ii cianobatteri ospiti dell’alga. Vi è poi il caso controverso dell’alga rossa Jania sp che sembra avere la capacità di produrre il precursore PST della STX, ma anche questo caso deve essere ulteriormente indagato. Se il dato dovesse essere confermato, significa che organismi evolutivamente distanti sono in grado di produrre la stessa identica molecola. In casi clinici di PSP, sono stati trovati, a volte, livelli elevati di PST oppure di STX, quindi la malattia è causata sia dal precursore che dalla saxitossina. Non è noto se la PST venga metabolizzata e convertita entro l’organismo in STX. Un'ipotesi suggerisce che questo avverrebbe per opera dei succhi gastrici, che convertirebbero la PST in metaboliti tossici più potenti. La STX è un alcaloide polare, solubile in acqua e insolubile in solventi organici. Nella figura sottostante è riportata la formula di struttura planare. Nella STX, R1,R2,R3,R4 equivalgono ad atomi di idrogeno. Nelle varianti gli indici R indicano altri atomi oppure altri gruppi.
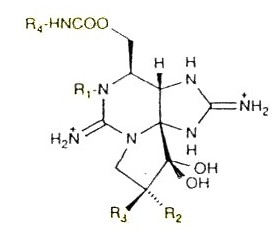
L’azione della STX è tale da alterae il funzionamento dei canali ionici, non solo del sodio come affermato in molti testi, ma anche del calcio e del potassio, interagisce inoltre con il funzionamento di alcuni sistemi enzimatici. Infine, la STX si lega con le transferrine che si trovano in alcuni vertebrati e negli invertebrati. I canali ionici del sodio si trovano nei neuroni, nelle cellule del muscolo scheletrico e del muscolo cardiaco. La struttura dei canali per il sodio del ratto è un eterodimero di 329 KDa, con una subunità α, e due subunità dette β1 e β2. Quattro subunità α formano il canale voltaggio-dipendente, le altre due unità β hanno invece un ruolo di regolazione. Si tratta di un modello semplificato di canale, poiché esistono più geni per le subunità proteiche e quindi più canali per il sodio (isoforme), diversamente sensibili all’azione della STX. E’ sufficiente una sola molecola della tossina per bloccare il canale, pur disponendo questo di quattro punti di ingresso per lo ione Na+. La STX ha dimensioni tali, almeno così sembra, da poter fisicamente alloggiare perfettamente entro la struttura del canale stesso, bloccando l’ingresso degli ioni sodio. Le STX, bloccando i canali del sodio (e del potassio), impediscono la generazione dell’impulso elettrico che scorre lungo gli assoni dei neuroni, di conseguenza è inibita la liberazione dell’acetilcolina e viene meno la comunicazione tra neuroni e cellule muscolari. Nei casi più gravi può sopraggiungere la morte per arresto delle funzioni respiratorie.
La struttura del canale del potassio non è molto diversa da quella del canale del sodio, e la sua caratterizzazione è stata possibile con l’identificazione del mutante shaker di D. melanogaster, il moscerino della frutta. Questi presentavano una mutazione di una proteina (espressione del gene go-go), con sequenza simile ai domini transmembrana del canale del sodio. Quattro domini diversi (non tutti identici come nel caso del canale per il sodio) formano infatti il canale principale, è presente poi una ulteriore subunità di regolazione di circa 40 KDa. Nello specifico STX agisce destabilizzando lo stato di inattivazione e stabilizzando lo stato chiuso, in particolare del canale hERG K+. Il canale del calcio, bersaglio di veleni specifici come quello di alcuni conidi e aracnidi, ha una strutture polipeptidica che forma domini simili ai canali visti fino ad ora. Cioè quattro domini formano il canale centrale e altri fungono da regolatori. La tipologia dei canali per i calcio è notevole. Canali di tipo P ed N sono presenti nei neuroni, mentre canali di tipo T ed L sono presenti nelle cellule muscolari cosi come nei neuroni. Bersaglio preferito della STX sembra essere il canale di tipo L.
Anche le transferrine (lattoferrina, ovotransferrina, melanotransferrina), sono un bersaglio per la STX. Si tratta di proteine pH-dipendenti che necessitano dello ione bicarbonato per formare legami con lo ione Fe3+. Attualmente sono in corso studi specifici su tessuti di anfibi del genere Rana. Queste proteine (dette saxifilline perchè capaci di legare naturalmente la STX) si trovano anche in altri phyla animali (altri anfibi, rettili, pesci come Fugu pardalis, insetti, ascidie e anche nell’alga Dunaliella salina). Il dott. Llewellyn dell’Australian Institute of Marine Science, ha sviluppato un metodo per individuare la saxitossina proprio grazie alle saxifilline. Resta aperta, per concludere, la questione riguardante il ruolo ecologico, biologico ed evolutivo della produzione della STX in particolare e delle tossine in generale, da parte di un gran numero di organismi marini. La sintesi dei metaboliti secondari è dispendiosa dal punto di vista del budget energetico. Allora occorre stabilire quale può essere il vantaggio evolutivo che predispone alla loro sintesi. Non esiste una risposta certa, forse produrre tossine significa per gli organismi aver la capacità di non esserne intossicati e quindi competere con altri per la sopravvivenza. Tra i procarioti la STX potrebbe interferire con la chemiotassi e/o il flusso extracellulare di ioni inorganici, quindi si tratterebbe di un meccanismo atto ad abbassare il tasso di competizione per le risorse. Per risposte esaurienti non resta che attendere.
CONSEGUENZE DELL'INTOSSICAZIONE DA SAXITOSSINA
Dopo circa 2 ore dall'ingestione la saxitossina causa collasso cardiovascolare e insufficienza respiratoria, poiché come spiegato sopra, agendo sui canali del sodio, blocca la trasmissione degli impulsi nervosi. Compare inizialmente (5 - 30 minuti dall'ingestione) ipotermia e un formicolio diffuso che comincia dalla bocca, dalle labbra e dalla lingua, per poi diffondersi al volto, al collo e al cuoio capelluto. In meno di un'ora il formicolio si estende a tutto il corpo, soprattutto alle estremità delle dita delle mani e dei piedi. Il tasso di mortalità varia dal' 1% al 22% e dipende ovviamente dalla dose ingerita. In un caso mortale, un pescatore che aveva consumato cozze bollite, furono trovati a livello gastrico, 370 μg/100 gr. di tossina. La dose di sicurezza non deve superare, nei prodotti contaminati, 80 μg/100 gr. La sindrome PSP deve essere immediatamente trattata ai primi sintomi. Opportuni immediati lavaggi gastrici e l'utilizzo di soluzioni alcaline, che inattivano la tossina, che sarà poi eliminata attraverso le urine. Non esiste nessun antidoto.
Questo articolo è protetto da Copyright © e non può essere riprodotto e diffuso tramite nessun mezzo elettronico o cartaceo senza esplicita autorizzazione scritta da parte dello staff di BiologiaMarina.eu.
Ideazione: Pierfederici Giovanni - Progetto: Pierfederici Giovanni, Castronuovo Motta Nicola, Guadagnino Marcello.
Prima Pubblicazione 31 Lug 2006 - Testi e immagini riproducibili secondo le specifiche Creative Commons. Le immagini dei Collaboratori detentori del Copyright © sono riproducibili solo dietro specifica autorizzazione.
Si dichiara, ai sensi della legge del 7 Marzo 2001 n. 62 che questo sito non rientra nella categoria di "Informazione periodica" in quanto viene aggiornato ad intervalli non regolari
XHTML 1.0 Transitional – CSS